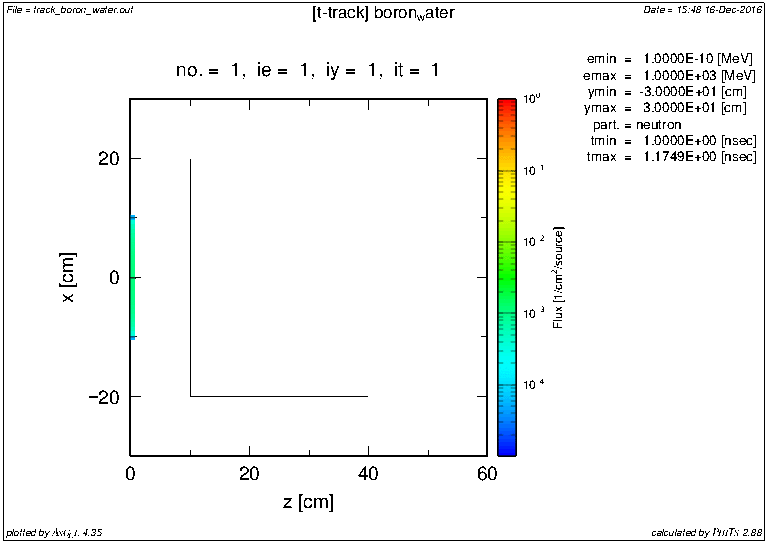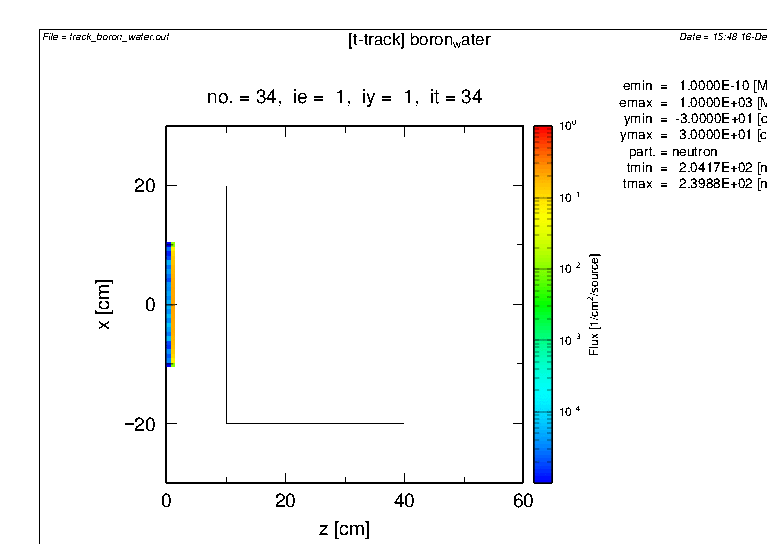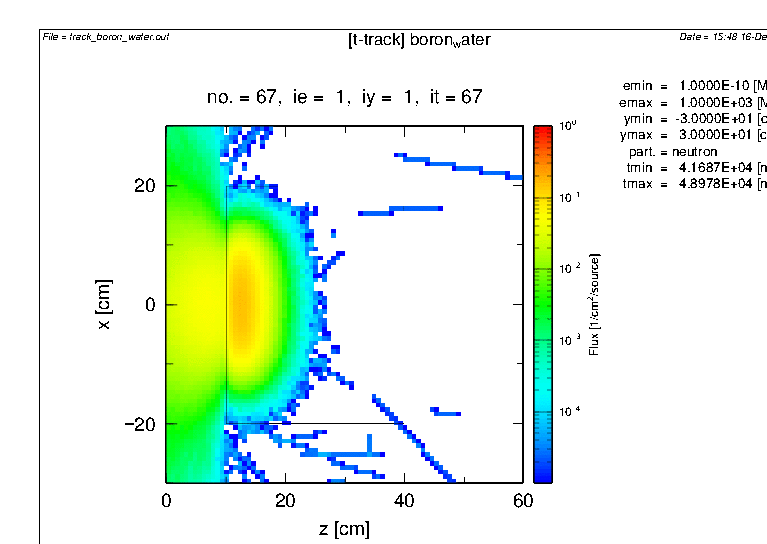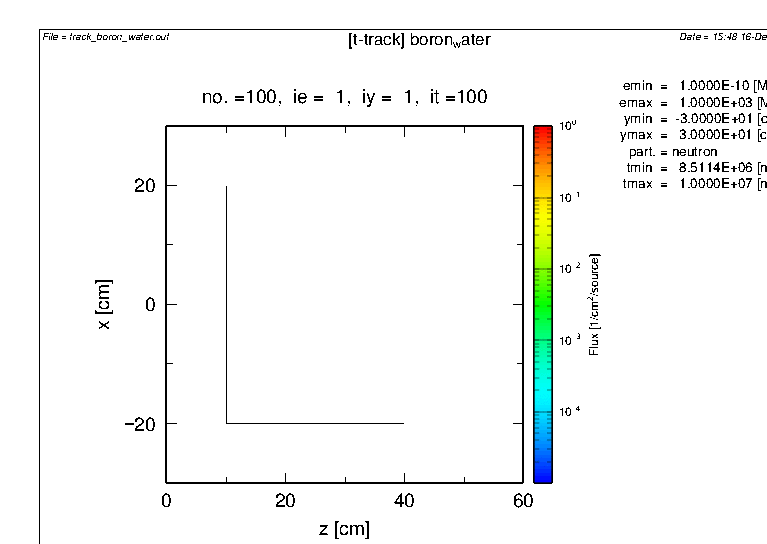短飛程放射線を活用した核医学治療薬剤の現状と将来
未承認放射性医薬品が医療法の規制対象となるように省令が改正されています。
放射線審議会第141回総会
議事録
○甲斐委員 従来RI法の対象であったものを医療法の中で規制をしていくという御提案がありましたけども、これについては省令だけではなくて、何らかの法令改正によってこの審議会に審議がかかってくるものになるんでしょうか。非常に大きな意味合いを持っていますので、審議会できちんと議論すべきテーマかなというような感想を持ちましたので、ちょっとお伺いしております。
○神谷会長 どうぞ。
○西田安全規制管理官 放射線規制部門の西田でございます。
RI法において規制対象となるものにつきましては、関係規則の中で定めておりまして、その中で医療法、薬機法に関するものは除くという形で記載をしております。したがいまして、今回医療法のほうでそれが対象になるということであれば、そういったものとの関連で、若干RI法のほうも修正を加えるという形になろうかというふうに考えております。
○神谷会長 ありがとうございます。そういうことでよろしゅうございますか。甲斐委員。
○甲斐委員 医療法に関する議論は、ここでは全く対象外ということになるんですか。
○厚生労働省 稲木課長補佐 それは厚生労働省からお答えさせていただきますと、医療法施行規則の改正になります。医療法施行規則の第24条の第8号において、診療用放射性元素は定義されておりますので、そこの省令改正という形になります。
○神谷会長 それでは審議官のほうからコメントをいただけますか。
○片山審議官 事務局のほうから申し上げますと、RI法と医療法の守備範囲をどういうふうに変えていくのかという話というのは、放射線障害防止の技術基準の斉一化という観点からいくと、少し放射線審議会の守備範囲の外の議論かなとは思っております。今の厚生労働省のほうから御説明があった施行規則、省令の改正というものとあわせて、規制庁から説明のあったRI法のこれは施行令、政令で守備範囲というものを決めているところはございますので、そこの改正というのをやることによって、この両法の守備範囲の変更という手続が完了することになります。それは我々事務局としては放射線審議会への諮問事項ではないのではないかというふうに思っております。
ただいずれにせよ新しく厚生労働省のほうで施行規則の改正をされた後に、恐らく退出基準をどう定めるのかといったような話が出てくれば、それは技術基準の斉一化という観点から、放射線審議会にお諮りをするということはあり得るということだというふうに思っております。
これを受けた規制整備の状況
放射性同位元素等の規制に関する法律施行令の一部改正について(報告事項)
現状の解説
国内未承認放射性医薬品の現状について
分子イメージング研究に関する各種コンテンツ
研究と放射線安全
新しい装置をアピールするために患者さんでデモ撮影したり、従事者をモデルにして画像をパンフレットにすることってありそうだけど、倫理上、適切なのかな?
昔はメーカーの営業の方が自らが被写体になる例もあり、そのような方は自分で手帳に記録を付けていたそうじゃ。
倫理的に妥当かどうかしっかり考える必要があるじゃろ。
では、研究での放射線利用にまつわる倫理を考えてみよう。
まずは用語の確認じゃ。
治験・臨床試験・臨床研究
治験ってなあに?
「くすりや医療機器の候補」を用いて国の承認を得るための成績を集める臨床試験とされておる。
臨床試験って何だっけ?
人を対象にした試験だ。臨床研究の一部とも言える。
臨床研究は、人を対象にした医学系研究だよね。
これも放射線と関係あるのかな?
臨床研究一般でよく使われている放射線
(1)臨床試験の対象となる医薬品や医療機器が放射線を発する
(2)放射線を何らかの指標取得のために用いる場合があるじゃろ。
原子炉で腫瘍の治療をするって聞いたことがあるけど、これも臨床研究だな。
臨床研究での放射線利用のルール
安全確保のためにどのようにルール化するかは、なかなか難しい問題であるようじゃ。
医療法ではどうなっているのですか?
H17.6月に省令改正がなされて、治験で非密封RIである薬物を用いる場合の放射線安全管理が医療法で規定されるようになっておる。
割と最近、ルールが整備されたのですね。
研究倫理の枠組みの制度化も立ち遅れていると指摘されているが、
次第に整備されており、臨床研究に関する倫理指針ができておる。
臨床研究の対象者の放射線安全は倫理的にどう考えられているのですか?
国や学会などからは特に考え方が示されておらん。
放射線が医療で活躍している割にはインフラ整備が今ひとつな感じがするね。
研究面では、まとまった論考がある。
指針がないと研究倫理審査委員会も大変そうだね。
研究倫理審査委員会がない医療機関などで臨床研究を行う場合にはどうすればよいのですか?
審査料を支払えば学会の研究倫理審査委員会で審査サービスを受けられることがある。
質のよい審査を行うところは人気が出るかもしれないね。
このような審査での倫理的な視点からの放射線安全評価の質はどうですか?
医療機関を対象にした調査が行われており、パイロット研究はまもなく論文が出版される予定じゃ。
この研究で実態が把握され課題が分析され、提言がなされている。
着実に前に進みつつあるようですね。
どんな問題がありそうですか?
専門的な観点からのレビューの質の確保が課題で、研究倫理審査委員会の前に外部の専門家がその部分だけをプレ・レビューする試みがされている。
論文の審査での統計学者のチェックみたいですね。
ガイドラインのガイドラインでも外部審査の有無はチェックポイントじゃ。
ご都合主義じゃないというのを制度化しようという訳ですね。
提出した研究計画書を自分で審査することがないように外部レビューを利用するというのは制度化するとよさそうですね。
被験者への説明
研究倫理審査では被験者への説明・同意文書が審査されると思うけど、
どのような課題がありますか?
健康ボランテイアに対しては放射線リスクを過小視していないかの確認が求められるだろう。
リスクを過小視して結果として、過去のボランテイア参加を隠して何度も治験に参加することは避ける必要がある。
患者負担軽減費によるインセンテイブですね。
個人の線量は調べられないのですか?
団体によっては登録しているボランテイアの過去の履歴を管理しているところがあるが、
一元的な管理はされていない。
医療従事者の個人線量管理と同じですね。
被験者保護の観点からは、リスク認知が妥当かどうか調べてもよいかもしれない。
どんな質問がよいですか?
臨床医なら普通に持っているX線のリスク認知との偏りを調べるのはどうじゃろう。
具体的には?
例えば、その年代で放射線誘発でがんを発症した場合の余命短縮が20年とし、
リスク係数を5%/Svとすると、
放射線部から実効線量で10 mSvと言われたX線CT検査だと、
リスクの大きさは、5×10-2×10-2=5×10-4
だから平均余命短縮は、20年×5×10-4=10-2年=4日となるが、
それと比べて極端に小さくないか確認してはどうじゃろう。
人間は期待値ではなく分散にかけるところがあるけど、この場合だと期待値の認知の確認でもよいかもしれないね。
リスク感覚を伝えるには、10 mSvのX線CT検査で受ける放射線の量は
・5年分の自然放射線
・ニューヨーク・東京往復50回フライト
・宇宙飛行士の10日分
で、
そのリスクの増加は、
・BGでも1/3ががんで死亡するのが、5×10-4増加する
1万人のうち約3千人はこの放射線の誘発ではないがんで死亡し、5人はこの放射線により誘発されたがんで死亡するということか。
もっとも、これらの推計は単純な比例計算で不確かさが大きい。
これ以上真のリスクが高い可能性は低いが、それよりも真のリスクが小さいことは否定できない。
リスクはあっても、この程度ということだね。
伝え方で印象が変わりそうだ。
倫理的にどうするのが正しいかは相手のコンピテンシーも吟味する必要がありそうだね。
患者ボランテイアの場合はどうですか?
相手が断りづらい状況にならないようにする必要がある。
例えばどうすればよいのかな?
相手の気持ちを察したコミュニケーションが重要じゃ。
献身的な医師の期待を裏切りたくないという気持ちが生じがちであることに十分自覚的であって、
断ることで医師は決してがっかりしないというメッセージをきちんと示したり、
さばけた治験コーデイネータが間に入り患者の気持ちにストレスを与えないことが必要じゃ。
このようなことは質のよいIRB審査ではきっちり審査されるじゃろ。
日本で放射性医薬品の治験ができないのは放射線防護の基準が厳しすぎるから?
日本では放射性医薬品の治験ができなかったという意見はよく聞きますが、本当ですか?
法令上の整理がきちんとついていなかったので、手続きは何パターンかに分かれるようじゃが、行われた実績はある。例えば、マウス型抗CD20抗体に90Yを抱合させた放射性免疫療法薬「Ibritumomab Tiuxetan(商品名:ゼバリン)」は米国FDAが2002年2月に認可した後、日本でも2004年8月より,臨床第2相試験が開始され,東北大学,群馬大学,国立がんセンター東病院,国立がんセンター中央病院,慶應義塾大学,東海大学,金沢大学,愛知県がんセンター,京都府立医科大学で,再発または難治性の低悪性度リンパ腫の患者を対象に臨床試験を実施されておる。
ゼバリンの放射線安全の説明資料例
日本は放射線防護の基準が厳しくて、放射性医薬品の治験がしにくいいう意見も聞くけど本当ですか?
確かに放射線管理に関する規制は各国で異なっている現状にある。
しかし,わが国の法令も,多くの諸外国と同様に,基本的には,国際放射線防護委員会の勧告や国際原子力機関の出版物に従ったものであり,他国と比較して,使用者等の行為基準に高いハードルを課しているという事実はない。
設備が大変という意見があると思うけど。
違いは排水設備などのコストや排水中放射能濃度限度の担保で、これが放射線治療病室の設置や運営に影響を与えていると考えられる。この背景には日本独自の排水濃度評価法があり、汚泥の処理法が未整備であることも関連要因と考えられるが、治験実施と直接の関係は弱いじゃろ。
診療報酬を手厚くして高コストで放射線安全面をより完全にするかどうかということですね。
医療機関の放射化の問題と同じで、世界標準とは離れた方向であるようにも思ってしまう。
どのようにバランスを取るかは、客観的な判断分析ではなく文化的な背景が大きいのじゃ。
無駄なコストはかける必要はないので放射線管理の最適化は重要じゃが、管理コストが必要なことを診療報酬改定で認められたのは意義あることだと思う。
必要な医療サービス供給量を確保するためどう体制を整えるかをみんなで考えた方がよいと思うな。
ICRP 94の貯留槽が必ずしも必要ないという議論は、どのような論理ですか?
これもバランスをどうとるかという論理で考えられておる。
放射性廃液では,公共下水等に放流する際の濃度限度を担保する必要がある.減衰させたり,希釈させ濃度限度以下にすることで下水道への放射性医薬品の排出が考慮すべきリスクをもたらすことはないが、医療機関では、多くの水道水を使用しているので、貯留槽を設けなくても、濃度が低くできる。
実情に合わせて評価すると言うことですね。
混入率も正直に設定した方がよいのだろうと思う。
TECDOC-1000では排水・排気基準は総量規制として与えている。
排水を飲むというシナリオではなく、下水処理場の汚泥へのトラップによる関係者の放射線曝露を制御しようとしておるのじゃ。
IAEAの考え方の方がすぐれているように思えてしまう。
気体はどうですか?
患者から排泄されたりするものでは、化学形を考慮して制御することが必要じゃろ。
その他の廃棄物は固体になりそうですが、廃棄の方法も考えた方がよいですか?
固形の廃棄物は放射性廃棄物として扱う必要がある。
医療系の放射性廃棄物は岩手県滝沢村市にある日本アイソトープ協会の施設に保管廃棄されている。
だから核医学関係者はみんな滝沢村市に感謝しているのですね。
この施設に貯えられる核種の種類は,滝沢村市との協定で制限がある。
また、将来、放射性廃棄物のクリアランス制度が導入されるが、クリアランスレベルの算出という観点では、新しい核種は評価しておくことが必要になるかもしれない。
他に廃棄物の問題はないですか?
可能性があるとすると複合汚染問題かもしれない。
放射性廃棄物であれば、何でも日本アイソトープ協会が引き取っていただけるわけではなく、放射線以外の安全が確保されていないと引き取れないので、複合汚染物になりうるものでは、最初に対策を考えておく必要がある。
未承認薬使用問題
未承認薬を早く使いたいという患者の意見には、どのような解決策が考えられますか?
早期承認だけではなく、海外からの個人輸入による治療では保険診療が認められず医療費全額が個人負担となることから、治験による特定療養費制度の拡大を求める意見もある。
問題解決のために、何か動きはあるのですか?
これらの問題の解決を図るため厚労省は「未承認薬使用問題検討会議」を設置し,早期の適切な治験促進を図るための措置を検討することとしておる。
治験が終わってしまったら薬が手に入らないというクレームもあるようだけど。
治験が終了した後も継続して患者が治験薬を使用できるよう,承認後の使用実態を想定して市販後試験の前倒しとして実施する「安全性確認試験」を承認申請後に行えるようになった。
治験は進みそうですか?
このスキームを使い未承認薬使用問題検討会議の決定をうけて,「承認のための治験」,「追加的治験」および「安全性確認試験」が行われることになる。
「承認のための治験」は薬事法上の承認申請を目的としたものだね。
「追加的治験」とは何ですか?
治験の対象条件に合致しない患者であっても,「追加的治験」として治験薬の投与が受けられることになる。
さらに,治験終了後(エンロール後)の患者への治験薬の供給の仕組みとして、
既に治験へのエントリーが終了した場合であっても,承認のための治験の一環として実施される「長期投与試験」に患者がエントリーすることができるようになった。
色々工夫しているのですね。
これらの治験や試験はGood Clinical Practice (GCP)が適応され,承認審査評価の対象となる。
この制度を利用してIbritumomab Tiuxetanはわが国でも臨床利用の道が開かれた。
医師主導による治験の仕組みは?
これまで治験は原則的には企業が行なうものであったが,企業での実施が困難である場合は医師主導による治験が実施できるようになった。
この場合,検査および画像診断などが保険給付の対象となる。
海外で承認された薬を個人輸入するのはどうですか?
海外で承認された薬を個人輸入する場合には,混合診療の対象となりうる。
ただし,これらの薬の個人輸入は,放射性物質の管理の観点から,放射線障害防止法の所持制限(第30条)事項の法令適用など,様々な課題がありそうじゃ。
このため放射性医薬品の個人輸入は行われていないが(事例があるようです、他の事例)、承認されている国で投与される例はある。
PETを用いた薬効等評価
PETを用いた薬効等評価が期待されているようです。
独立行政法人放射線医学総合研究所重粒子医科学センター画像医学部は,陽電子放射断層撮像(PET)を用いて,新しい抗うつ薬(LY248686)の適切な用法・用量の設定に参考となるデータを得るための治験を既に平成16年度に実施しておる。
放医研ニュースにあったものですね(別の例)。
塩野義製薬株式会社からの受託で株式会社エクサムの治験コーディネーター支援により行ったものじゃ。
放医研では分子イメージング研究センターを2005年11月1日に発足させこの領域の研究を推進している。
既に,抗うつ薬では,SSRI(選択的セロトニン再取り込み阻害剤)などの効果判定のためにセロトニンを再び神経細胞内に取り込むたんぱく質の働きを調べることができる分子プローブの臨床研究が開始されている。
また,肺がん治療薬ゲフィチニブが上皮成長因子受容体(FGFR)に結合して作用を発揮することを利用し,そのたんぱく質に結合するプローブ薬剤も開発されておる。
中性子捕捉療法
放射線を用いて医薬品の効果を評価するということですね。
PETの機能診断を用いて薬剤の有効性を検証することは優れた方法なので、その普及のための環境整備が求められそうですね。
中性子捕捉療法はどうですか?
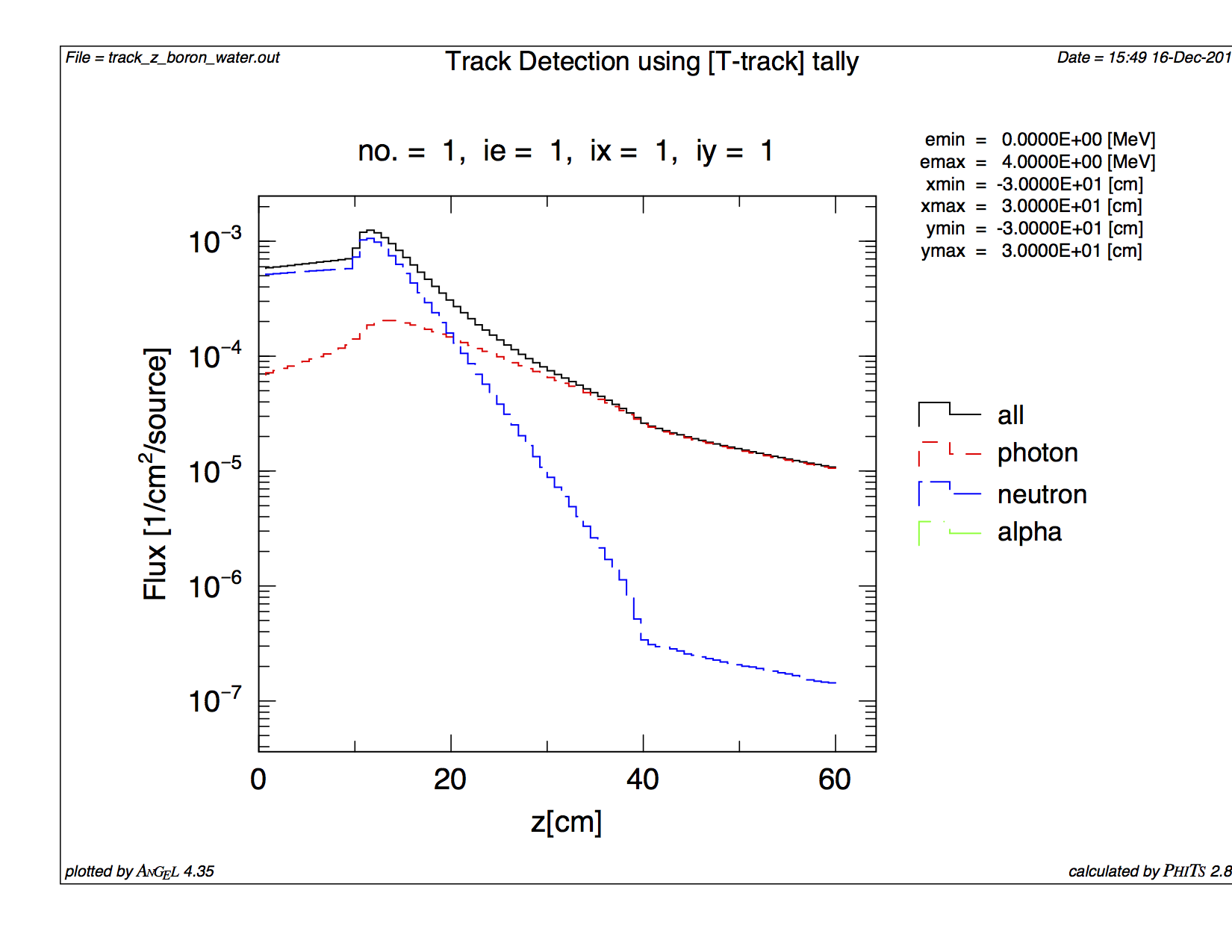
中性子捕捉療法では,中性子の捕獲断面積が大きいボロンを腫瘍内にいかに効率的に取り込ませるかが重要な課題じゃ。
ボロンを腫瘍細胞に取り込ませるために,ウイルスのエンベロープを使う方法も模索されているが,現在,実用化しているのは,bonorophenylalanine(BPA)を用いる方法じゃ。
BPAはアミノ酸輸送系を介して細胞内へ取り込まれるため,腫瘍細胞内へのホウ素の取り込みは周辺の血管増生に依存する。
このため,治療計画には腫瘍細胞内のホウ素濃度を把握することが必要となる。
そこで,18Fを標識したFBPAを用いて,PET検査によりホウ素濃度を推計する方法が注目されており,その法令適用が今後課題となりうるじゃろ。
これまでの指針作りの例
参考になると考えられる先行例はありますか?
放射性物質・放射線を用いた治験の環境整備としては,血管内放射線治療の例がある。
この事例は,冠動脈疾患の再狭窄防止のために32Pを用いたステント等の利用が検討されたもので,「血管内放射線治療の治験における安全管理に関するガイドライン」が,日本アイソトープ協会医学薬学部会,日本放射線腫瘍学会,日本血管造影・IVR 学会,日本医学放射線学会,日本心血管インターベンション学会,日本心臓病学会,日本循環器学会,医療放射線防護連絡協議会により作成された。
このガイドラインでは,治験実施施設の条件として,
・ 法令上の手続きをおえていること
・ 放射線科医が常勤していること
・ 治験担当部門のスタッフが,学会等が主催する本治療法に関する教育講習を受講していること
が定められておる。
ガイドラインに基づき教育研修が行われ、この活動が基になり,臨床応用できるように医療法施行規則も改正された。
ただし,血管内放射線治療は治験が行われ有効性が確認されたものの,その後,より優れた方法が開発されたため普及には至っていない。
しかし,取り組みの手順としては,永久刺入線源の利用同様,参考になるじゃろ。
線量の推計
内部被ばく線量推計は線源臓器の放射能が刻々と変わるから難しいイメージがあるけど、どうすればよいですか?
代謝に関するデータがあれば、コンパートメントモデルで任意の時刻での線源臓器の単位投与量あたりの放射能が与えられるから、それからS値(評価臓器での線量換算係数)を用いて計算することができる。
最近は、体格などに応じたS値もボクセルファントムを用いて計算可能じゃ。
核データも整備されており、関係する学会で研究活動が続いており、ビジネスとしてツール開発会社もあるので、連携するとよいのではないかな。
ツールは色々あるので、とりあえず計算するのは容易そうですね。
ポイントは何ですか?
腫瘍の治療の場合には、疾患部位へのエネルギー付与は安全評価としての線量推計から除くことと、意図しない集積をきちんと考慮し、推計しておくことじゃろ。
被爆者援護法での原爆症認定や被爆者認定での紛争では、従来主要と考えられていたエネルギー付与の経路以外をどう考えるかが問われておる。
過去の薬害の反省に立って、新しいチャレンジでは幅広い分野の専門家の吟味を求めるべきじゃろう。
長文を最後まで読んでいただきありがとうございました。
日本核医学会
生物医学研究志願者の放射線防護に関する提言
分子イメージング戦略会議とPET核医学委員会による基準や認証制度
被験者放射線防護についての考え方 第1報一日米英制度比較と国内アンケート調査から
NEDO
Lu-177-DOTA-TATE治療
Lu-177-DOTA-TATEの適正使用に関する報告書と適正使用マニュアル(第2版)を掲載
イットリウム(90Y)を結合させたArmed抗体を用いた抗がん剤治療
抗がん剤「FF-21101」進行性固形がんを対象とする国内臨床第Ⅰ相試験を開始
文献
被験者放射線防護についての考え方第1報一日米英制度比較と国内アンケート調査から
核医学診療施設における研究ボランティアの放射線被ばくの現状と今後の課題
― RIを投与する臨床研究または治験を受けるボランティアの被ばくに関するアンケート調査報告 ―
医師主導治験
厚生労働科学研究費補助金 (医薬品・医療機器等レギュラトリーサイエンス総合研究事業) 医師主導治験等の運用に関する研究
総括研究報告書
日本アイソトープ協会医学・薬学部会放射性医薬品専門委員会.国内未承認放射性医薬品の現状について(3)
栗原 千絵子, 堀口 隆司, 鈴木 和子, 須原 哲也.研究者主導臨床研究における倫理・信頼性確保の試み(第一報) ―脳内タウイメージング用放射性薬剤[11C]PBB3 の多施設連携研究での経験から―
アルファ線核医学治療薬TAH-1005([211At]NaAt)による分化型甲状腺がん(乳頭がん、濾胞がん)患者を対象とした第I相医師主導治験
関連取り組み
厚労省・がん診療提供体制のあり方に関する検討会(第6回)
資料5 核医学治療(RI内服療法、RI治療、標的アイソトープ治療)に関する現状(東参考人提出資料)
分子イメージング戦略会議
分子イメージング戦略会議は、PET臨床研究の質の向上を図り、PETの研究成果を医療に普及させるための道筋を整えることを目的に、2010年2月に設置されました。これまでに、PET臨床研究のためのガイドラインの策定と施設認証制度の構築を行う一方、新しいPET診断薬や検査法が円滑に医療に普及するように、規制当局や企業と対話を行い、外国の学術団体とも連携しています。
矢野 恒夫, 渡辺 恭良.RIを用いたマイクロドーズ臨床試験とその創薬実用化への展望
福島県立医大
大阪大学
医療機器
世界初となるリチウムターゲットの病院設置型BNCTシステム 原子力安全技術センターの施設検査に合格
BNCT(ホウ素中性子捕捉療法)実用化推進と拠点形成に向けた検討会議
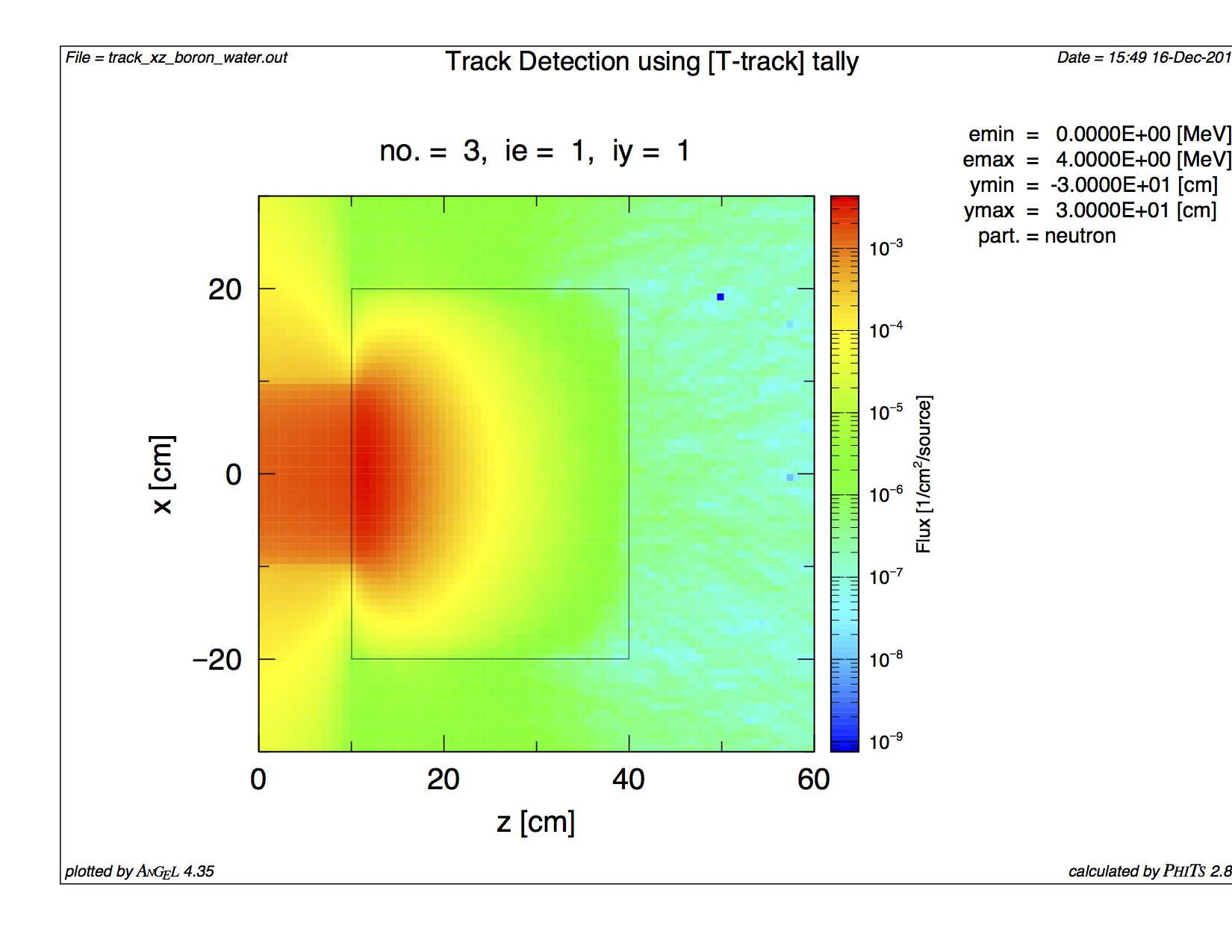
10 eVの中性子をB-10を20ppm含む水に入射させたところ。
10 eV neutrons are being irradiated to water with B-10 (20 ppm).
全経過時間は10ms(対数スケール)。
Total preset time is 20ns (log scale).
B-10を含まない場合
trajectory without B-10
B-10を含まない場合
trajectory without B-10
α線による線量
dose of alpha particles
百万個の中性子の入射で4,475個のα線が発生しています。
B-10を含まない場合
trajectory without B-10
α線による線量
dose of alpha particles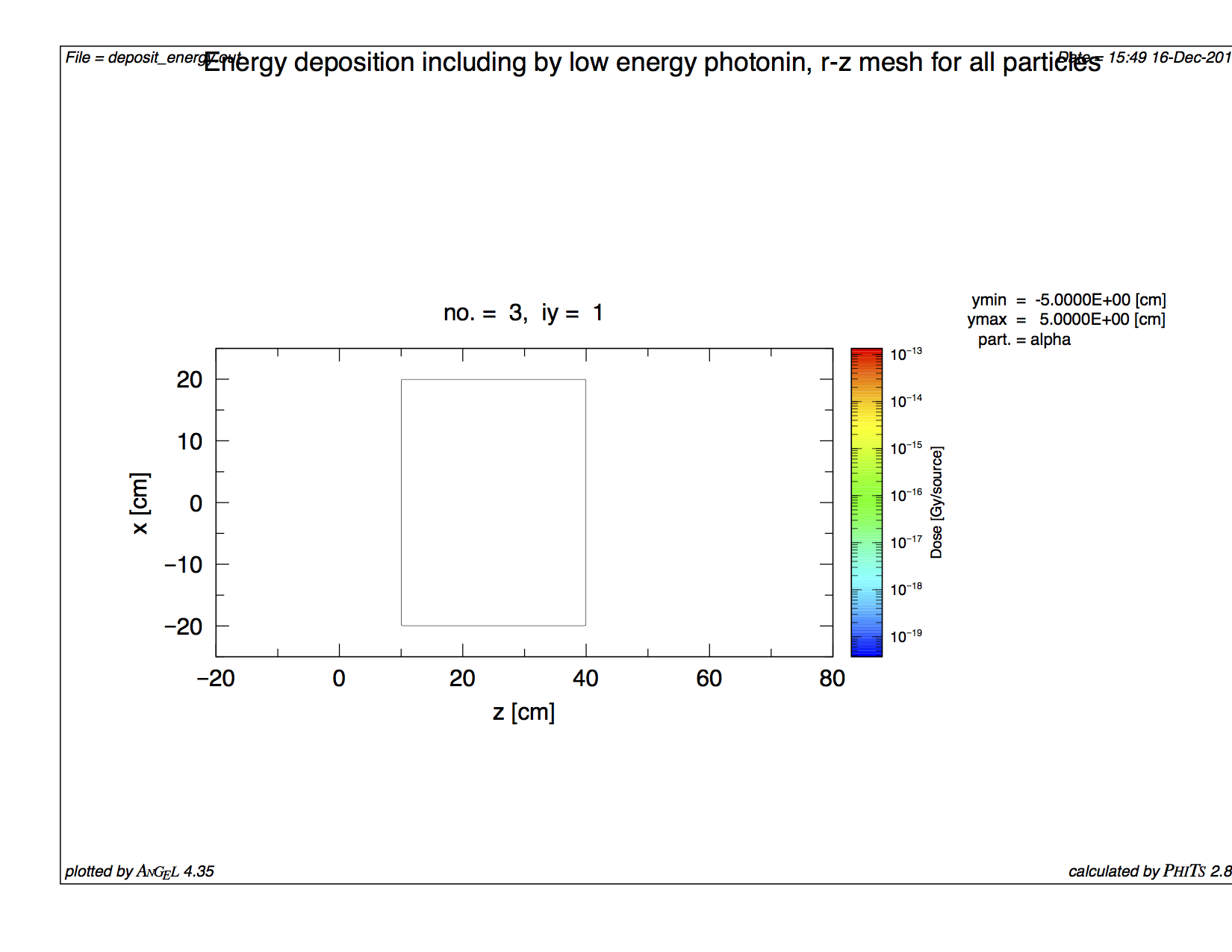
百万個の中性子の入射ではα線が1つも発生していません。
B-10を含まない場合
trajectory without B-10
被験者の募集
放医研
座談会
神経内分泌腫瘍の核医学診断と治療~今後の展開~
欧米で実績のある神経内分泌腫瘍(NET)の新しい治療-ペプチド受容体放射性核種療法(PRRT)とは
核医学治療 (RI内用療法、RI治療、 標的アイソトープ治療) に関する現状
東達也, 池渕秀治, 内山眞幸, 織内昇, 絹谷清剛, 細野眞. RI 内用療法の将来展望と提言. 核医学 2016; 53: 27–43.
倫理に配慮した研究例
大山 正哉, 上田 隆司, 木藤 哲史, 伍賀 友紀, 田仲 隆, 荻野 尚.患者呼吸模擬ファントムシステムを用いた呼吸同期照射法に対する照射位置の評価
健常なヒトに放射性物質を投与した研究例
長崎大学
緊急時被ばく線量評価におけるホールボディカウンター全身スキャンによる甲状腺線量測定の妥当性の検討
(臨床研究承認番号 13102351)
臨床研究法
GMP
厚生労働科学研究
院内製造PET薬剤の合成装置を用いた核医学診断技術に係る規制体系、臨床応用に関する諸外国の状況調査に関する研究
日本核医学会
分子イメージング臨床研究に用いるPET薬剤についての基準
学会製造基準の認証を取得した施設
慶應義塾大学病院
福島県立医科大学
医用サイクロトロンシステムCyclotron system仕様書
岡山大学大学院医歯薬学総合研究科産学官連携センター
QST
治験薬GMP製造
院内製造PET薬剤の「製造基準」の教育プログラム
鈴木 和年, GMP指向型PET薬剤製造施設, RADIOISOTOPES, 2002, 51 巻, 9 号, p. 369-379, 公開日 2010/07/21, Online ISSN 1884-4111, Print ISSN 0033-8303
質問主意書
医療機器の審査の国際的な調和
医療機器の審査に携わるアジア各国の担当者を対象にした研修の機会がPMDAにより提供されています。
1st PMDA Medical Devices Training Seminar
アジア医薬品・医療機器トレーニングセンター
その写真にも写っている韓国MFDSの李博士が書かれた関連する論文例。
李昌炯.韓・米・日における医療機器の承認審査の現況について
患者会
厚生労働省
新しい放射性同位体の研究
Yuichi Hatsukawa , Toru Tanimori. 95gTc and 96gTc as alternatives to medical radioisotope 99mTc
関係する団体
倫理の問題を考える
米国
21CFR361.1
TITLE 21–FOOD AND DRUGS
CHAPTER I–FOOD AND DRUG ADMINISTRATION
DEPARTMENT OF HEALTH AND HUMAN SERVICES
SUBCHAPTER D–DRUGS FOR HUMAN USE
PART 361 — PRESCRIPTION DRUGS FOR HUMAN USE GENERALLY RECOGNIZED AS SAFE AND EFFECTIVE AND NOT MISBRANDED: DRUGS USED IN RESEARCH
Sec. 361.1 Radioactive drugs for certain research uses.
IAEA
Biomedical research involving radiation exposure
GSR Part3
3.161. The medical exposure of volunteers as part of a programme of biomedical research is deemed to be not justified unless:
(a) It is in accordance with the provisions of the Helsinki Declaration [20] and takes into account the guidelines published by the Council for International Organizations of Medical Sciences [21], together with the recommendations of the ICRP [22];
(b) It is subject to approval by an ethics committee (or other institutional body that has been assigned functions similar to those of an ethics committee by the relevant authority), subject to any dose constraints that may be specified (as required in paras 3.149(a)(ii) and 3.174), and subject to applicable national regulations and local regulations.
3.166. Registrants and licensees shall ensure that the particular aspects of medical exposures are considered in the optimization process for:
(c) Volunteers subject to medical exposure as part of a programme of biomedical research;
3.174. Registrants and licensees shall ensure that dose constraints specified or approved by the ethics committee (or other institutional body that has been assigned functions similar to those of an ethics committee by the relevant authority) on a case by case basis as part of a proposal for biomedical research (para. 3.161) are used in the optimization of protection and safety for persons subject to exposure as part of a programme of biomedical research.
record
3.183. Registrants and licensees shall maintain for a period as specified by the regulatory body and shall make available, as required, the following personnel records:
(e) Exposure records for volunteers subject to medical exposure as part of a programme of biomedical research;
Specific Safety Guide No. SSG-46: Radiation Protection and Safety in Medical Uses of Ionizing Radiation
Ethics committee
2.99. Participants in a programme of biomedical research may be either patients, with some disease or ailment, or they may be healthy individuals. Regardless,
they should be volunteers. The ethics committee12 has a particular responsibility with respect to justification of medical exposure of volunteers exposed as part of a programme of biomedical research (para. 3.161 of GSR Part 3 [3]). The first part of this responsibility is to decide whether to approve the programme of biomedical research, including the proposed use of radiation. The use of radiation in a programme of biomedical research can include:
12 The ethics committee is the term used in GSR Part 3 [3] to refer to a committee dedicated to the rights and well-being of research subjects. Other terms, such as institutional review board, are used in some States.
(a) The use of a diagnostic radiological procedure to assess the efficacy of the treatment under investigation (e.g. ranging from a DXA scan to measure bone mineral density before, during and after a given treatment regime, to a CT or a positron emission tomography (PET)–CT examination to assess some clinical indicators, again performed before, during and after the treatment);
(b) Trials being performed to assess a new radiopharmaceutical (i.e. the radiation itself is part of the research, rather than a tool for assessment);
(c) Trials being performed to assess a new radiotherapy protocol alone or in combination with other therapeutic modalities;
(d) Trials being performed to compare radiological procedures, for example specificities and sensitivities of different imaging procedures or efficacy of different treatments;
(e) Trials being performed to assess physiological and/or biochemical processes in healthy individuals.
In making its decision, the ethics committee should be presented with correct information on the expected doses and estimates of the radiation risks based on the age, sex and health status of the participants. The ethics committee should also obtain information on who will perform the radiological procedures and how. The dose estimates and the associated radiation risks should be assessed by a medical physicist. This information should be then considered by the ethics committee together with the information on the other risks and benefits of the programme.
2.100. The ethics committee has the responsibility to specify any dose constraints that are to be applied to the doses incurred as part of the approved programme of biomedical research. Such dose constraints would be guided by nationally or regionally established dose constraints (see para. 2.50). Dose constraints should be adjusted to the expected benefit of the programme of biomedical research: the lower the benefit to society, the more stringent the dose constraint. The ICRP stratifies doses incurred in biomedical research according to radiation risk [27] and in Ref. [4] assigns numerical values of dose constraints ranging from less than 0.1 mSv to greater than 10 mSv, as the benefit to society ranged from minor through to substantial. Less stringent dose constraints may be applied for participants with short life expectancy (e.g. see Ref. [28]). Particular attention should be given to setting dose constraints for healthy volunteers who repeatedly take part in biomedical research programmes that expose them to increased risks.
2.101. Ethics committees might not be aware of these responsibilities. Therefore, the radiation protection regulatory body should act as a facilitator in promoting systems so that the ethics committee knows about its responsibilities when a proposal for a programme of biomedical research that includes radiation exposure is submitted to the ethics committee. Such a system may include a standardized proposal form that includes the question ‘Will ionizing radiation be used as part of this programme of biomedical research?’ If the answer is yes, the form should then request information on radiation doses and risks to be provided, having been first assessed and signed off by a medical physicist.
2.102. In parallel, the regulatory body should inform the registrants and licensees that radiological procedures requested as part of a programme of biomedical research are justified only if that programme has been approved by the ethics committee, and that such an approval is subject to dose constraints, which would then influence how the procedure would be performed.
New Radiopharmacy Database
Enhancing Development, Collaboration and Research
臨床試験とSNS
How Facebook and Twitter could be the next disruptive force in clinical trials
岩手県議会
平成16年2月定例会 本会議(3月2日) 伊沢昌弘議員)
次に、社団法人日本アイソトープ協会が滝沢村に設置している茅記念滝沢研究所、いわゆるラジオメディカルセンターについてお伺いいたします。
この施設は、昭和62年から医療用アイソトープ廃棄物を、日本アイソトープ協会が全国の医療機関から集荷して処理をしている施設ですが、建設計画が明らかになった昭和50年代後半から完成時点まで県議会でも多くの議論が交わされ、持ち込まれる放射性廃棄物は19核種、医療系のものに限ると説明されてきたものであります。ところが、平成13年8月に、滝沢村長に対して、アイソトープ協会が集荷・貯蔵するすべてのアイソトープ廃棄物を処理するために、研究所等から排出されるアイソトープ廃棄物も同一敷地内で処理する目的で施設増設の申し出があり、地元住民に対する説明会が開催されたと伺っています。
研究用アイソトープの処理を追加して滝沢村のラジオメディカルセンターで行う理由として、国において、ごく低レベルのアイソトープ廃棄物を一般の廃棄物とみなす、いわゆるクリアランス導入を検討しており、もしクリアランスが実施されれば、現在搬入されている医療用アイソトープ廃棄物のほとんどが、通常の産業廃棄物として扱われることが予想されることを掲げ、処理実績のある滝沢村の施設で集中処理を行うということが効果的であると説明をしているわけであります。このことに対して、一部の地域住民の中には、半減期の短い医療用アイソトープと異なり、200種を超え多岐にわたる核種の研究用アイソトープ廃棄物が新たに持ち込まれることに不安を訴える人もおります。近隣市町村にとっても大きな問題であり、県としても県民に対して情報を提供する必要があると考えますがいかがでしょうか。
また、県もラジオメディカルセンターの誘致に深くかかわり、公害防止協定の締結にも立会人として調印し、公害防止協定に基づいて設置された放射線監視委員会に委員を派遣していることから、新たな施設の建設について承知していたと思われますがいかがでしょうか。県として、これまでラジオメディカルセンターに対してどのように対応してきたのかお示しをいただきたいと思います。
あわせて、今後の対応についてもお示しをいただきたいと思います。
また、滝沢村ではこの新たな申し出について、現在どのような検討をしているのかお示しをいただきたいと思います。
加えて、現在、国で検討している放射性廃棄物のクリアランスが導入されれば、医療用アイソトープのほとんどが一般の廃棄物扱いとなることについてどのようにお考えでしょうか。これらとあわせた御見解をお示しいただきたいと思います。
〇環境生活部長(中村世紀君)
次に、ラジオメディカルセンターに関しましてのお尋ねでございますけれども、まず、県民の皆様への情報提供についてでございますけれども、基本的には当事者であります滝沢村とそれから社団法人日本アイソトープ協会が行うべきものであると考えてございます。
ラジオメディカルセンターに対して県がこれまでどのような対応を行ってきたかということでございますけれども、ラジオメディカルセンターにおきましては、現在、低レベルの放射性廃棄物の処理が行われておるところでございます。この処理につきましては、安全性が確保されることが最も重要であると考えておりまして、県におきましては、環境放射能水準調査というものを実施しております。これの一角といたしまして、昭和63年度から毎年、ラジオメディカルセンター施設周辺の農産物等について調査を実施してきているところでございますけれども、これまでのところ、自然界での放射能レベルを超えるような状況は観測されておらないところでございます。
また、新たな施設の建設計画についてでございますけれども、県は滝沢村及び日本アイソトープ協会から新たな施設の建設計画につきまして情報提供を受けているところでございます。滝沢村では、協会からの申し出を受けまして、役場内の検討組織のほか、村議会に調査特別委員会を設置いたしまして、検討を重ねていると聞いておるところでございます。
協会自体は、昭和62年の操業開始以来、現在まで安全性に配慮いたしまして、関係法令を遵守した操業を行ってきておるところでございます。したがいまして、県といたしましては、当面この新しい施設の建設計画につきましては、滝沢村での検討及び滝沢村と協会との間で行われております協議の進捗状況を、関心を持って見守りたいと考えてございます。
また、いわゆるクリアランスレベルの導入に関してでございますけれども、この導入につきましても、当然安全性が確保されることが最も重要であるわけでございますけれども、放射性物質の使用・廃棄などの取り扱いは、放射線障害防止法などによりまして国直轄で規制していることでございますので、放射性廃棄物の安全管理対策についても国の責任において適切に行われるべきものと考えてございます。この問題、クリアランスレベルの導入でございますが、これにつきましては、現在、国の委員会におきまして専門家による科学的な議論が行われているところでございますので、この検討の結果を見きわめたいと考えているところでございます。
伊沢昌弘議員
RMCについてお伺いをいたします。
ラジオメディカルセンターでありますが、環境生活部長の方からは御答弁をいただいたわけでありますが、私、これ50年代、本当に県の誘致企業として19核種の、半減期が非常に短くて医療用に使う放射性廃棄物を持ってくるのだと、私たちの健康に十分に寄与するものが最終的に滝沢村で保管をされて安全に措置をされるということで、県議会の中でもそういう御答弁がずっと続いていたわけであります。公害防止協定が結ばれていますけれども、この中でも、研究用のものを持ってくるとか、半減期の長いものだとかというものは含まれていなかったと承知をしているわけであります。環境生活部というのは、放射能汚染があるのかないのか、これは言ってみれば監視を行う部署であります。誘致をしたり、その企業がどのような新たな計画を立てるのか、きちんとした業務内容を含めて審査をしながら、いわば許可をするというセクションが県にとっても必要なのではないかと思うわけであります。環境生活部で監視をしながら新たなものについて、これ許可権限も何もないわけでありますけれども、県としては放射性廃棄物が持ち込まれる、それも新たなものが持ち込まれるということを考えれば、別なセクションできちっとした対応をすべきだと思うわけであります。放射性の医療系廃棄物に限られたものが研究用も含めて200種以上を超えるということについて、県としてはどのような御所見をお持ちなのか、どなたに答えてもらえばいいのか私もちょっとわからないわけでありますけれども、改めてお願いをしたいと思うんです。自治体と協会が話をしていると、その推移を見守るというだけでは、県民に対しての責任が私は果たせないと思う観点で重ねてお伺いをしたいと思います。
〇環境生活部長(中村世紀君)
ラジオメディカルセンターが取り扱います研究用の廃棄物、これを新たに持ち込みたいという、そういう処理工場を建設したいということで、今、村に協議をしているわけでございます。これについての県の考え方ということでございました。
前段、環境生活部、監視担当であるので、放射性廃棄物持ち込みの是非はもっと別なセクションできちんと組織をつくって検討したらいいのではないかというお話もございましたので、私がお答えしてしかるべきかどうか大変恐縮でございますけれども、最初の御質問にお答えいたしました関係上、申しわけございません、私の方からお答えをさせていただきます。
今回、日本アイソトープ協会が滝沢村に協議をしております研究所用等の廃棄物の処理施設をつくりたいという申し出でございますけれども、この廃棄物、私が承知しております限りでは、直ちに非常に安全性が保障できないものという認識はしてございません。
きのう、本会議におきまして高レベル放射能の最終処理施設についての議論があったわけでございますが、現時点で、一見して安全性がまだ確保されていないというものではなくて、極めて低レベルの放射能を含む廃棄物であると認識してございまして、これをもって直ちに安全性が損なわれるという認識はしてございません。ただし、そのゆえをもって、村が導入といいますか処理施設の設置に同意をするかしないかということは、これはまた別の問題でございます。地元としては地元としていろいろな立場での考え方もあろうと思いますし、県といたしましても、直ちに安全性が損なわれると認定するほどのものではないけれども、だからといって全くの危険性があるのかないのか、どういう影響があるのか、そこまでの詳しい調査を今している、識見を持っているものでもございません。本来、これにつきましては、事業者であります国、この場合は国の指揮を受けます日本アイソトープ協会でございますけれども、協会がみずからの責任で安全性について十分な説明責任を果たすべきものと考えてございます。どういう説明責任をこれから果たしていくのか、その推移を見守りたいと考えているものでございます。
〇36番(伊沢昌弘君)
すれ違いの部分も多くあるんですが、RMCについてしつこいようですがお伺いします。
今御答弁いただいたように、環境生活部長のところでは、この問題について新たな申し出があった際に、どのような核種でどういうものなのかというのは御説明を受けたが、きちんとした形でわかっていない――わかっていないというのは大変失礼なんですが、協会の方も県に対して教える必要がないというふうに思っているんじゃないかと思うんです。法的に県が同意するというものではないと私も承知していますが、かつて19種の医療系の放射性廃棄物を持ってくるときに、県議会としてもいろんな議論をしたわけであります。そのときには19の医療系だけですよと、思われるというくだりもあったわけです。しかし、半減期が非常に長いものも研究用にはあるんじゃないかと。医療用の研究だけじゃなくて原子力そのもの、そのほかのいろんなところで使っている核種もあるから200種を超えるものがあると思うんです。そうしますと、私は県として危機管理の関係から含めて、こういう施設が今後どうなるかということを考えれば、組織管理の中できちっとした対応をここがやりながら、そしてこの施設はこういうもので、機種はこういうもので、核種はこういうもので、どういう形態を持って半減期がどのくらいで、最終的にはこのような措置をするのだというのが議会にも教えていただかなければならないと思うんです。だれか知っている人いますか。いないはずです。それぞれのところで、役場の方に出された検討委員会なり、それから滝沢村議会の方に出された全員協議会の資料を入手すればできるわけですが、県として、これはそういうものがあって、私たちにも、県民を代表する県議会の方にも、これは県としての同意事項ではないが、こういう形で動いていますよというのをやるべきだと思うわけであります。
重ねてお伺いしますが、今の時点で200を超える核種がどうのこうのと言ってもお答えがいただけないかと思います。別な意味で、環境生活部以外で新たなこういうものができて将来的に新しく設置をされるというときに、県として検討するセクション、危機管理という考えで言えば語弊があるかもしれませんが、そういった部分をつくるお考えがないのかどうか、ここは総務部長の方からの御答弁をぜひ賜りたいと思います。
〇総務部長(時澤忠君)
ただいま御質問のありましたラジオメディカルセンター関係につきましては、環境生活部長の方から答弁いたしましたように、現在環境生活部において対応しているところでございます。これは現在進行形のものでございますけれども、危機管理につきましても、これは例えば健康被害、財産に損害が生じるというときには、危機管理対応ということで現在マニュアルを策定しておりますが、この所管につきましても、放射能関係施設の事故につきましては環境生活部の方で所管をしているということになっているものでございます。したがいまして、一義的に現在環境生活部の方でこの問題に取り組んでいるわけでございますが、事象によりまして環境生活部だけで対応できない、あるいはその他のことが出てきた場合には柔軟に対応できるように連絡会議等の設置も含めまして、必要な支援については検討していきたいと考えております。
〇副議長(菊池勲君)
環境生活部長に聞きますけれども、県議会にも知らせる必要があるのではないかという質問があるけれども、その点はどうなんですか。
〇環境生活部長(中村世紀君)
ラジオメディカルセンターの設置がいろいろ議論になりました、たしか昭和50年代の後半から60年代初めにかけてのことだったと思います。そのときにいろいろな議論がありまして、県議会でも御議論があって、そういう紆余曲折といいますか、いろいろな議論を経て公害防止協定を事業者の協会と村が締結をしている。それに県の担当部長が立会人という形で三者協定を結んで操業を開始したという経緯がございます。御指摘のとおりです。
今回、協会が滝沢村に新たに協議をしておりますのは、これの変更ではなくて、それはそれといたしまして、全く新しいものを、研究用のものを、医療系というものを前には処理するのだという協定なわけですが、医療系のものではなくて、研究所から出たものを新たに持ち込みたいと、処理をしたいということで、変更ではなくて新しい提案だと理解してございます。この提案につきまして、県議会の皆様方に御報告を今までたしかしておらないわけでございます。ただ、きょうの議論といいますか御質問等もございました。必要があれば、皆様方に御報告をできる方途を今これから考えてみたいと思います。
〇副議長(菊池勲君)
必要があらばではなくて、必要だから今質問しているわけだから、やる気があるのかどうか。どうなんですか、その点は。
〇環境生活部長(中村世紀君)
私どもが承知しております情報につきまして、県議会の皆様に御報告できるように、その方法について検討してみたいと思います。
〇48番(小原宣良君) 関連をさせていただきます。
ただいま伊沢議員の方から質問のあったラジオメディカルセンターへの新たな研究用の種類について搬入をするという問題でありますが、先ほど環境生活部長の答弁の中で、日本アイソトープ協会はしっかりと説明責任があると、説明責任を果たすべきだという認識が示されました。ならば、部長が低レベルだから危険性はないと認識しているという趣旨の発言が前段にあったわけですが、これは撤回をする必要があると、このように思います。そこのところの私の質問の趣旨はおわかりかと思いますが、その見解を尋ねます。
〇環境生活部長(中村世紀君) お答えいたします。
明らかな危険性があるという認識はしておらないと申し上げました。しかし、危険性が全くないと現在断定したものでもないと。したがって、これらについてのその危険性の度合いの説明責任は、事業主体であります社団法人日本アイソトープ協会が十分な説明責任を果たしていただくべきものだと、こう申し上げたつもりでございますので、御理解をいただきたいと思います。
平成16年2月定例会 予算特別委員会会議録 (第5号) 平成16年3月12日(金曜日)
〇吉田昭彦委員長 これより本日の会議を開き、直ちに議事に入ります。
議案第1号から議案第21号まで、議案第23号、議案第29号から議案第31号まで、議案第33号から議案第36号まで、議案第39号、議案第41号、議案第43号、議案第47号及び議案第48号の以上34件を一括議題といたします。
本日は、環境生活部及び保健福祉部関係を終わるように進行いたしたいと思いますので、御協力をお願いいたします。
また、質疑につきましては、世話人会の申し合わせにより、質疑項目が複数ある場合、関連する項目についてはできるだけまとめて質疑されるとともに、各委員の発言の機会を保障するため、1人の委員の質疑が長時間に及ぶことのないよう、質疑及び答弁は簡潔明瞭に行い、午後5時を目途に審査が終了するよう議事進行に御協力をお願いいたします。
なお、関連質疑については、冒頭に質疑を表明している委員より優先して発言を認めているものでありますので、その性格上、関連性の強いもののみ、短時間、簡潔に発言されるよう、また、要望のみで終わることのないよう御協力をお願いいたします。
最初に、環境生活部長から環境生活部関係の説明を求めます。
なお、皆様のお手元に配付いたしております資料、社団法人日本アイソトープ協会滝沢研究所における新事業計画について(概要)は、議案に関する説明に引き続き説明を求めますので、御了承願います。
〇環境生活部長(中村世紀君)
お答えいたします。
県といたしましては、このような考え方に基づきまして、確実な、例えば核種の特定、それから協定外の核種を持ち込みする場合には事前協議を行うこと、あるいは処理した後の廃棄物の搬出は確実に実施するなどなど、できる限りこの新事業計画の安全性を担保するための仕組みにつきまして、事業主体のアイソトープ協会と滝沢村との間で協議が行われ、協定などの具体的な措置が取り決められることが望ましいものと考えてございます。必要があれば、協会や村に対する助言も検討してまいりたいと考えてございます。
〇斉藤信委員
最後です。きょう冒頭に部長から、日本アイソトープ協会滝沢研究所における新事業計画について報告がございました。伊沢委員の本会議での質問に答えたものであります。
私は、そこにかかわってお聞きしたいんだが、これは新事業計画ということで出されていまして、研究用の放射性廃棄物の処理は、日本原子力研究所東海研究所で一部処理しているというだけですね。なぜここだけでしか一部処理できなかったのか、これの理由を示していただきたい。
その結果、平成14年末の貯蔵量は7万本になっているわけですね。これは大変なことです。そして、滝沢村で研究用の処理をやった場合、この7万本が滝沢村に来るということになると思うんです。ですから、これは大変重大な問題で、今までなぜやれなかったのか。
それと、研究用の放射性廃棄物というのは、いわば排出事業者が主にどこなのか。わざわざ岩手まで持ってこなければならないものなのか。恐らく私は関東とか関西が中心ではないかと思うんです。それをわざわざ岩手まで運んで処理しなければならないものなのか大変疑問を感じます。それが2点目です。
3点目に、この問題については、焼却をして、一定期間貯蔵後、搬出となっています。いわば最終処分は別だよという意味なんですね。しかし、この研究用の放射性廃棄物については、最終処分が決まっていないんじゃないでしょうか。結局これが決まってなければ、実態としては滝沢の研究所が最終処分になってしまうんですよ、現実問題としては。私は、これは全く片手落ちの対策ではないか、そういうふうに感じますが、いかがでしょうか。
4点目に、今、医療用の廃棄物が処理されて保管されていますが、これが平成14年度末で2万本となっています。貯蔵施設能力は2万2、000本です。もうほとんどいっぱいなんですね。これは、どういうふうに処理される見込みでしょうか。これは大変深刻な話ですよね。医療用の処理自身が大変深刻な状況になっているのではないか。医療用については、焼却、圧縮、破砕、保管廃棄施設において保管となっているんですね。その後の処理はするという方向はないわけですね。結局、最終的に、今までの医療用廃棄物もどういうふうに最終処分されるのか。
最後ですが、先ほどの部長の説明を聞くと、何か県が安全性を自信を持って説明しているように見受けられました。そうではなくて、先ほどの説明はあくまでもアイソトープ協会の計画を説明したと。アイソトープ協会にかわって説明したということだと思います。県として安全だというふうに今の段階で説明すべきじゃないし、そして、これは最後の最後ですが、これは風評被害なんかも含めて地域に重大な影響を与える問題です。地域住民との合意と理解と納得というのが最大の条件だと思っています。そういう点でも部長の見解をお聞きしたい。
〇中村環境生活部長
数点御質問がございましたので、順を追ってお答えいたします。
まず、研究用の分、なぜ原子力研究所の東海研究所で一部だけ処理してそのほかは処理されていないのかということでございますけれども、処理というのはどういうことかその前に申し上げますけれども、処理というのは、この場合は、焼却をして減量するというのが処理の基本的なやり方でございます。そういう処理施設が東海研究所にあったので、そこでは処理をしているわけです。ほかの研究施設はどうなのかというと、処理をしないでそのまま減量しないで保管だけをしている、そういうのが実態でございます。
次に、研究用の排出者、滝沢村に持ち込んでくるところはどこかということでございますけれども、現在、研究用のこれをやっておりますのは全国で約1、600事業所ございまして、大学の理学部、工学部、農学部、医学部あるいは試験研究所等でございますので、排出者は全国からということになるものでございます。
それから3番目でございますけれども、一定の処理をした後、搬出する最終処分の関係でございますけれども、これは、焼却処理をして、一定期間貯蔵後、搬出する、アイソトープ協会の計画ではそうなってございます。会議の冒頭、私、御説明申し上げましたが、このあたりについて、制度的あるいは計画上はきちんと安全性は確保されているけれども、例えば一定期間貯蔵後、搬出の一定期間というものが、一定期間とはいつなのかというようなときに、例えば3カ月後であるとか半年後には必ず搬出するとか、そういうようなことを村と協会との間できちんと取り決める、できれば協定にそういうことをきちんと盛り込むということが必要である。そうでなければ、あるいは委員が御懸念のように、なし崩しに一定期間なるものが何年も10年も続いてしまうというようなことになってはまずいので、その辺はきちんとやるべきだということを県の考え方として御説明を申し上げたわけでございます。
最後でございますが、県としてどう考えているんだということですが、冒頭の御説明は、アイソトープ協会が滝沢村に協議をしております新しい事業計画の概要を説明をいたしました。あわせて、これに対する県としての考え方も御説明を申し上げた。二つのことを御説明申し上げたつもりでございます。
〇斉藤信委員
2番目の排出先の問題では、大学、試験研究機関では全国だと。しかし、密度があるんですから。私は、大学や試験研究機関だということになれば、やっぱり主には関東、関西ということになると思うんです、密度からいったら。だから、滝沢まで持ってくるというそれ自身、決して合理性がないのではないか。もっと近いところで処理するのが当然ではないかと私は思います。新しい事業計画なんですから。それについて私はお聞きしたい。合理性からいったら、近いところで処理する。岩手県は自県(圏)内処理と言っているんだから、何もそこまで我々が請け負わなくていいのではないかと思います。自県(圏)内処理という立場からいって、新しい核のごみを、放射能汚染のごみを受け入れる必要はないのではないか。
それと、三つ目の一定期間貯蔵後、搬出と、今、部長さんは3カ月とか何とかと具体例を挙げました。そんな話じゃないでしょう、実際には。3カ月後にどこかに持っていくんですか。研究用の放射性廃棄物というのは半減期が例えば5、730年とか100年とか12年とかですよ。今までの医療用廃棄物であれば59日とか28日とかなんですよ。そういう意味では全然レベルが違うんですよ。だから、私は、最終処分という考え方が求められてくると思うんです、この問題については。研究用の放射性廃棄物は最終的にどこで処理するという国の計画はあるんですか。また、処理施設の中で処理するという考え方なのか、そのことを国の計画としてどうなっているか示していただきたい。そして、一定期間とここで書いたことは、部長が言うように3カ月とか6カ月とかという、そういう都合のいい話なのかどうか、これははっきり答えていただきたい。
最後ですけれども、滝沢村に……(「最後が10回目だぞ」と呼ぶ者あり)あなたほどでもないんじゃないか。ラジオメディカルセンターが導入されたときに、実は、これは県も一緒になって誘致したということがありました。そして、村を二分する大問題になった。私はそれだけに、今回新しい事業計画で、既に協定書があって、一度は滝沢村は協定の変更を拒否しているんですよ。だから、私は本当にこれは慎重な対応が必要で、日本アイソトープ協会の代弁のような立場を県はとるべきでない。あくまでも滝沢村の対応を見守るべきだと思いますが、いかがですか。
〇中村環境生活部長
まず、全国から集まってくるのを引き受けるのは合理性がないということでございましたけれども、この放射性物質の処理は、廃棄物処理行政とは若干異なってございまして、国の直轄行政ということになってございます。
今回は、国ではなくて文部科学省の主管法人であります社団法人日本アイソトープ協会が事業主体となっているわけでございますけれども、国の考え方といたしまして、やはり放射性の処理施設、小さいものをぽつぽつ建てるのにも限界があるので、どこかで一元的に処理をしたいということで、いろいろな候補地を実は検討していたのだそうです。その結果、滝沢村にお願いをしたいということで来たという経過があると承知してございます。そういう理由で滝沢村に今協議があるというものだと理解してございます。
それから、処理をした後の取り扱いがどうなるかということでございますけれども、減量処理をしたものにつきましては、最終的に国が最終処分場を整備して、そこで処理をするという計画になってございます。なってございますが、現時点で最終処分場の場所をまだ国は決めておりませんというか、見つけられていない状態になってございます。したがいまして、処理はするけれども、そのままでは行き先がないというのが今の状態です。だから、行きようがないものをそのまま処理をした滝沢村に積み上げておくということではなくて、もとの研究施設に保管しているものを減量のために滝沢に持ってきて、そこで減量の処理をする。処理をしたならば、またもとのところに戻す、そういう形を、期間を決めて持ち帰れということをきちんと村はアイソトープ協会に申し入れをして、それを協定書に明確にする必要があると私が申し上げているのはそこのところでございます。協会の方は、一定期間経過後に搬出する、今、そういう提案をしているわけですが、一定期間という期間を明示させる必要があると考えているものでございます。
いろいろな議論が当時、昭和62年から今の医療系をやっていろいろなことがあったんですが、あのときはまたあのときで企業立地との関連もあったりして、安全性の問題もあったけれども、いろいろなこともあった。今回は、そういうこととはまた事情がかなり違っておるわけでございますが、いろいろな御意見があることは確かにそのとおりでございまして、滝沢村におきましても、これをどのように取り扱うべきかということに対して村議会に特別委員会を設置していろいろな検討をしておると聞き及んでございます。地元の意向は当然十分に尊重されるべきものだと思ってございます。県は県としてのそういう考え方を必要があれば助言をする、こういう立場だというふうに思っております。
〇伊沢昌弘委員
当該委員でございますけれども、ただいまのRMCの問題で、資料をおつくりいただいてきょう御説明いただいたということで、あえて手を挙げさせていただきました。
斉藤委員が私の疑問点も含めて言った部分が多いんですが、部長、私、本会議場でこれを取り上げて、再質問で総務部長にも、担当部のところ、何としても環境生活部がやるんですかと。今までかかわってきて、環境問題も含めて委員会の中に課長が入ってかかわってきた。よって、いろいろな意味での問い合わせ等を含めて、これは中村環境生活部長のところで担当せよ、こうなったようですが、今、お話あったように、62年スタートの段階で、50年代、56、57年、58年あたりに企画調整部が企業誘致との絡みでやっていて、最終的には、62年の6月の公害防止協定には、村長とアイソトープ協会の会長茅誠司さんと、岩手県知事〇〇ならわかるんですが、岩手県企画調整部部長〇〇の判こで協定に立ち会いになっている部分があるんです。その延長があって、私はやっぱり中村環境生活部長のところで担当するというのは、できてからの監視というのは十分わかるんですが、今までのように御説明をいただいて、アイソトープ協会の考えの中で御説明をいただくというのは、どうも私不都合があるんじゃないか、こう思うんですが、改めてそこの部分をお聞かせいただきいと思うんです。
〇中村環境生活部長
県の内部でどこが担当するのかといういろいろな議論があったわけでございますけれども、当時、昭和62年に医療系を処理したときは、企業誘致担当部門がこの問題を担当してございました。その後、立地が決まりましてから、企業立地のいろいろな附帯施設等の誘致の方がまだ懸案として残っておった。それともう一つ、操業開始したから安全確保しなければならない。具体的には、周辺農地のモニタリングということで、安全対策に関する面は環境サイドがやる、それから、地域振興といいますか、誘致あるいはそれに関連するいろいろな関連産業、地域振興については企業立地サイドが担当するということで、ずっと県庁の中でそういう役割分担をしながら今日まで推移してきた経過がございます。
最初、この安全監視委員会ですか、協会、村、地域住民、それから県も安全のための監視委員会に入っているんですが、そのメンバーも企業立地担当が入ったままスタートしてございましたけれども、やはりこれは環境保全というか、環境監視という観点から対応すべきだということで、平成11年に事務の引き継ぎをいたしまして、企業立地担当から環境担当にその監視委員会の事務を引き継いだという経過がございます。
今、どうなのかということですが、私、きょう資料を提供して御説明をしたわけでございますけれども、あくまでもこの研究用放射性廃棄物の導入に関して、安全であるか否かという観点から資料を提出して、その観点から御説明を申し上げました。これを積極的に誘致すべきか誘致すべきでないか、誘致することによって、例えば地域の活性化につながるのかつながらないのか、その影響はとか、そういう面での立場から申し上げたものではございません。あくまでも安全面という面から資料を提出して、その安全性についてはきちんと協定を結んで、計画がきちんと実行されるような形を整えれば安全と考えるということを申し上げたものでございます。
〇伊沢昌弘委員
私もこれをずっと振り返ってみると、19核種の医療系廃棄物、きょうの資料の中にも最大長くて59日の半減期だと、これが隣の方を見れば最大5、730年だと。これも上位五つの中に入っているという形があります。群では2から4という形で、毒性だとかいろいろな部分がある。よって、わからないということだと思うんです。要は、協会から出たいろいろな資料は、20年近くやってきたけれども、何ら問題がなかったと。これをひっくり返せば、半減期がこれしかないものがよしんば飛んだにしても、作物の影響をとっていくと、春植えた米を秋にとる、春先にもし飛んだものが残っていることを考えれば、これは出てきませんよ。ところが、5、700年も半減期があるものがもし飛んだとしたら、これはどうなりますか。よって、今までの部分で問題がないのだからいいのだという形が果たして言えるかなというところをやっぱり一つ考えてほしいと思います。
それと、現在まで研究用が保管されているというのは、東海村を含めて、言ってみれば高レベルのところがいっぱいあります。雰囲気も含めて、いろいろな地域の放射線をはかったものは全国的にもデータが出ています。本県よりもたしか自然の放射性のものが高いというところも各地区ではデータが出ているわけです。そんな中でもし飛び出したということがあっても、低レベルのものがカウントされているのかというと、わからないと思うんです。そういったことも踏まえて、私もきょうの説明を聞いて、部長がいろいろ安全性も含めて問題がなかったと。これは、アイソトープ協会の資料に基づいての御説明だと思うわけですけれども、今、滝沢村は議会中です。きのうも本会議を含めて質問が出ているそうであります。県や国等のいろいろな意見も聞きながら対応しなければならないということになっているという状況のもとで、改めて、先ほど必要があれば助言も考えていきたいと。その助言は、協定の中に期間を入れるとかという観点ではなくて、もっと広い分野から、県として、先ほどの半減期の問題も含めて、毒性の問題も含めて十分な対応をしていただきたいものだ、こういうふうに思うわけであります。
20年前に比べて騒ぎが起きてないというのは確かです。しかし本当は、あのときに19核種であれだけ騒いだものが、今、この研究用のものが出てきたときに皆さんが余りお騒ぎにならないというのは、なれっこになっている部分も当然あると思うんです。これが私は怖いなという思いがありますので、改めて部長、そういった意味でこの問題について対応のあり方をお聞かせいただきたいと思います。
〇中村環境生活部長
今回、研究用、確かに半減期が非常に長いものが持ち込まれます。半減期が長いということは、改めて申し上げるまでもなく、放射能を発散するのがなくならないまま長期間滞留するということでございますので、医療用のように最終処分地が見つかるまであそこの倉庫にドラム缶に入れて積み上げておくのではなくて、一定期間という期間をきちんと示して、そこでしたものはそこに積み上げておかないで最初の研究機関に返すということがぜひ必要であろうということを申し上げているのでございます。
それから、過去の経験で、例えば茨城県の東海研究所でも事故がないと申し上げました。それから、申し上げたかどうかちょっと失念しましたが、滝沢の医療用のここでもきちんと監視委員会が正常に機能しておりまして、データはオールオープンでございますし、こんなことを言ってはなんですが、持ち込みに批判的な方さえも監視委員会に賛成反対を問わず入ってもらってきちんとチェックをしているという非常によい体制で監視をしております。その結果、こちらも事故がなかった。だからそれでいいのだということではないと。それはそれで、やはりせっかくこういう新たな提案があるので、きちんと初心に立ち返って、新しい提案ですからやっていくべきだと。
具体的には、今、取り扱い133の核種だとか225の核種だとかという、19種類限定ではなくて非常にいっぱい持ち込みする核種がふえる、主要なものは五つだけなんですけれども、ふえることになっております。したがって、核種を特定しないで研究用のものは全部持ち込むというような提案、このアイソトープ協会の文書からだけ見るとそういう提案になっております。やはりこれでは問題があるので、核種を限定して、安全性が確認されるこれとこれとこれは持ち込み対象ですと。もしそれでなくて、また技術の進歩とかいろいろなことで新しい核種も処理したいというのであれば、それはそれで持ち込む前に村と事前協議をするとか、そういうような形で、運用の面できちんと安全性が確保されるような対策を講じる必要があると考えているものでございます。
医療安全の観点から
Developments in nuclear medicine: new radioisotopes and associated challenges
Mark Konijnenberg. EVALUATION OF RISKS OF RADIONUCLIDE THERAPY
線量評価
問題提起例
大野和子.新薬の治験プログラムを見て疑問に感じたこと.医療放射線防護 NEWS LETTER 2000.9 No.29
医療機器の審査
新医療機器の審査報告書の公表について
質の高い製造販売承認等申請のためのガイダンス
産総研コンソーシアム 医療機器レギュラトリーサイエンス研究会
PMDA
東北大学
革新的医療用ラジオアイソトープ製造施設整備に向け始動
DATE プロジェクトが拓く国産診断治療用アイソトープ医薬品開発
DATEプロジェクトが拓く国産診断・治療用アイソトープ医薬品の開発
量研機構
認知症治療薬開発へのとびらをひらくPET薬剤の開発に成功-脳内タウ病変の可視化による病態解明、早期診断、新規治療薬の開発促進に役立つ-
国会
第204回国会 参議院 決算委員会 第8号 令和三年五月三十一日(月曜日)
説明
患者団体からの要望
全国がん患者団体連合会が核医学診療推進の要望書を提出
我が国における核医学の推進に関する要望書の提出について
Y-90での検討例
核医学診療における放射線防護に関する管理基準策定に関する検討
導入時の検討資料の例
アスタチン
難治性甲状腺がんに対する医師主導治験を開始 ~アスタチンを用いた新しい標的アルファ線治療~
アルファ線核医学治療法開発プロジェクト
QiSS
生体内で安定して機能するアスタチン-211標識法を開発
労働者の安全確保
高リスク群神経芽腫を対象とした小児 MIBG 治療における看護師の被ばくの実態調査
放射性医薬品開発研究
医薬品の開発の課題
飯田真一郎,澁口 朋之,吉田 昌生.ドラッグ・ラグ:なぜ、未承認薬が増えているのか?
運搬
未承認放射性薬物の取扱いについて.第5回 医療放射線の適正管理に関する検討会(資料 3)平成 30 年 4 月 27 日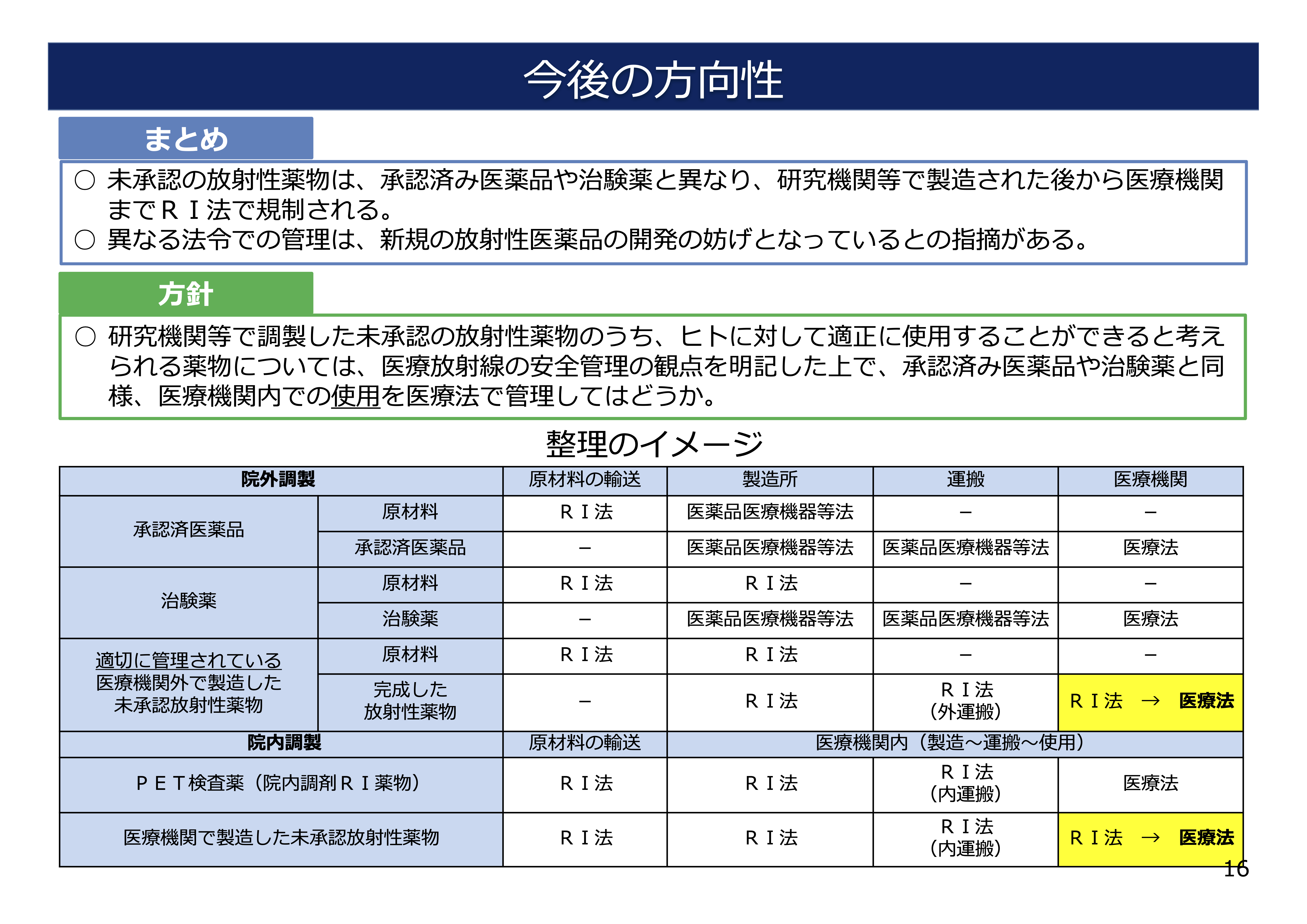
運搬は医療法での規制がこの時は想定されていましたが、RI法による規制と整理されました。
放射性医薬品の製造及び取扱いに関する業界自主基準について.厚生労働省医薬・生活衛生監視指導・麻薬対策課(事務連絡 令和3年8月2日)
譲渡譲受の場合
第4回放射性同位元素等規制法に係る審査ガイド等の整備に関する意見聴取
法令上は、まず荷出し側の事業所内運搬があって、事業所外運搬があって、荷受側の事業所内運搬がある
特区
厚生労働省関係構造改革特別区域法第三十四条に規定する政令等規制事業に係る省令の特例に関する措置を定める省令
医薬品から医療機器か?
体外診断用医薬品は、医薬品ですが、規制の枠組みとしては、医療機器のような扱いになっています。
臨床試験
アルファ線核医学治療薬TAH-1005([211At]NaAt)による分化型甲状腺がん(乳頭がん、濾胞がん)患者を対象とした第I相医師主導治験